日本におけるiPS細胞の誕生は世界中の患者に光明をもたらしました。このブレイクスルーは再生医療分野の研究を飛躍的に加速させ、すでに臨床応用への道も開かれています。ボゾリサーチセンターも研究者の皆様の開発を支援するべく、国内で先駆けて再生医療等製品のGLPを取得し、種々の安全性試験を展開しています。多くの難病・傷病患者を救うため、再生医療等製品の安全性試験においてもリーディングカンパニーを目指します。
※ GLP下での実施を検討中ですが、現状は外部委託の受託業務となっております。
上記フローは開発例です。個別の開発ケースに応じ異なる場合があります。詳細は弊社営業部までお問い合わせください。

iPS細胞の発祥国である日本でも、再生医療等製品の開発経験は多くありません。製品の由来や製造方法が多種多様である等の理由から、非臨床安全性評価においては製品の特性を把握した上で、柔軟かつ合理的にケース・バイ・ケースでの対応が必要です。行政当局も、より有効で安全な再生医療等製品が開発されるよう、早い段階で薬事戦略相談等を活用されることを推奨しています。

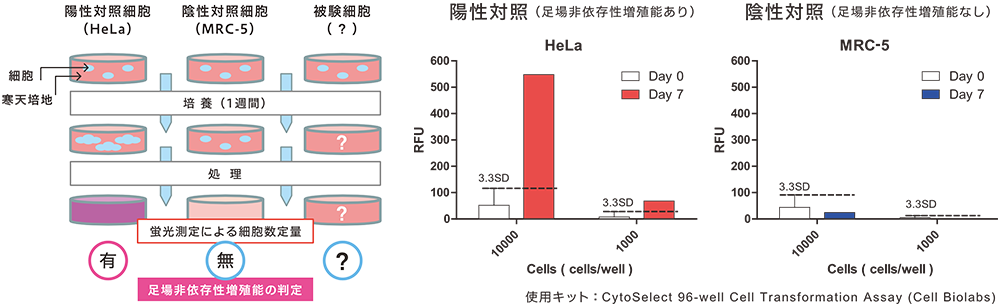
HeLa細胞(がん細胞、陽性対照)、MRC-5細胞(正常細胞、陰性対照)及び被験細胞を軟寒天培地中に分散させ、1週間培養します。それぞれの細胞について、培養開始時(Day 0)と7日後(Day 7)の細胞数を測定・定量化し、対照細胞と比較することで被験細胞の造腫瘍性を評価します。
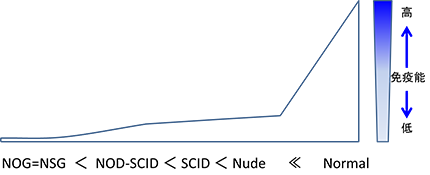
・免疫不全マウスと造腫瘍性試験**
ヒト由来の細胞は、正常マウスでは生着しにくく移植が困難です。これはレシピエント側の免疫拒絶反応によるものです。免疫不全マウスはこの免疫能を著しく低下させ、異種移植を可能にした動物です。このマウスにヒト細胞由来の再生医療等製品を移植・投与し、その造腫瘍性や一般毒性を評価します。
**ボゾリサーチセンターは、2014年4月に(公財)実験動物中央研究所との共同研究契約を締結して、NOGマウスを用いた再生医療等製品における安全性評価試験法を確立し、製品に応じた評価を行っています。
非臨床試験サービスに加え、病理組織学検査(標本作製、病理診断)、GLP対応保存、翻訳(英訳・和訳)を一部受託業務としても実施しており、他施設でおこなわれた試験についても多数の取扱い実績を有しています。
試験のご依頼・ご相談はお電話、もしくはお問い合わせフォームよりお問い合わせください。
03-5453-8101
営業時間:平日9:00~17:30(土日・祝日・年末年始除く)